办理条件
1、产品研制、生产工艺文件规定的要求
2、有保证医疗器械质量的管理制度
3、有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员
4、有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备
5、有与生产的医疗器械相适应的售后服务能力
申请材料清单
1、产品技术要求
2、《第一类医疗器械备案表》
3、产品说明书及最小销售单元标签设计样稿
4、符合性声明
5、临床评价资料
6、风险分析报告
7、产品检验报告
8、授权委托书
9、生产制造信息
10、证明性文件
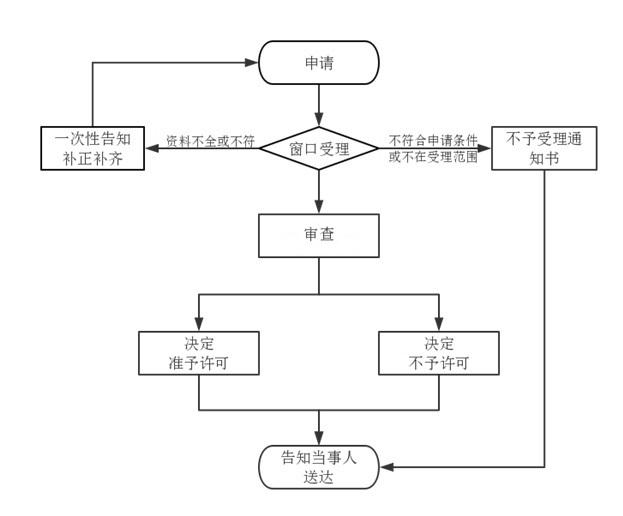
办理流程
凯纳德相关服务
●产品技术要求审核
●产品临床评价资料审核
●产品标签,说明书,包装文件审核
●产品检测要求确定
●产品备案资料编写与定稿
●产品技术要求确认
●产品备案资料递交
广东凯纳德企业管理咨询有限公司
联系人:汪先生
热线:0757-83836955
QQ:530756778
地址:广东省佛山市南海区桂城季华东路31号天安中心7座303A
专业ISO9001认证、ISO14001认证、ISO45001认证、IATF16949认证等体系认证咨询机构
Copyright © 广东凯纳德企业管理咨询有限公司 版权所有 粤ICP备19080410号-2